05 Enero de 2022 17:08
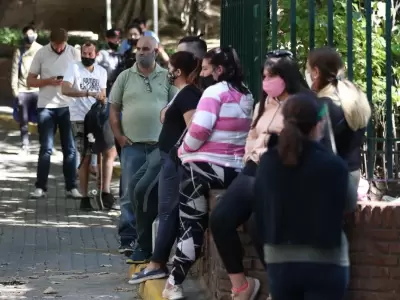
El Ministerio de Salud informó que se registraron 95.159 nuevos contagios y 52 muertos por coronavirus en las últimas 24 horas. Según el reporte diario del miércoles 5 de enero, hay 5915695 de casos confirmados y, en total, se llegó a 117.346 víctimas fatales en la Argentina. En tanto, los casos os activos suman 407.825 y las personas dadas de alta totalizan 5.390.524.

Durante la última jornada fueron realizadas 170.639 pruebas para detectar la enfermedad, y, en total, ya son 28646641 los testeos llevados a cabo en el país desde el inicio de la pandemia. La tasa de positividad continúa subiendo y supera el 10% recomendado por la Organización Mundial de la Salud (OMS).

Hasta el día de la fecha, la cantidad de internados por COVID en unidades de terapia intensiva (UTI) del país son 1.396. En tanto, el porcentaje de ocupación total de camas en las UTI adulto es del 37.2% a nivel nacional, tuvo un aumento del 2% en comparación con el día de ayer y del 38.1%% en el Área Metropolitana de Buenos Aires (AMBA).
La aprobación de los autotest
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó el uso individual de cuatro test de autoevaluación en base a la detección del virus SARS-CoV-2 de los laboratorios Abbott, Roche, Vyam Group y Wiener de venta exclusiva en farmacias.

Los productos aprobados sonn Panbio COVID-19 Antigen Self-Test, SARS-CoV-2 Antigen Self Test Nasal, SARS-CoV-2 Antigen Rapid Test (COVID-19 Ag), WL Check SARS-CoV-2 Ag Self Testing. Su utilización es la orientación diagnóstica y los usuarios deben recoger la muestra por sí mismos en base a las instrucciones de los fabricantes.
Alarma por los contagios en los chicos no vacunados: internaciones y la dura advertencia de los médicos
La decisión de Anmat se tomó en base a la documentación presentada y a partir del consenso surgido en las reuniones del Consejo Federal de Salud (COFESA) y de la solicitud del sector privado de poder sumar herramientas de autocuidado en el contexto de la pandemia.

Los test de autoevaluación para la detección de SARS-CoV-2 (COVID-19) podrán adquirirse de modo individual, por instituciones públicas o privadas, o jurisdicciones siempre que se garantice el adecuado reporte de resultados.
Según explicaron los profesionales de la salud, estas pruebas proporcionan resultados orientativos, sin valor diagnóstico concluyente, a excepción de que las jurisdicciones, en acuerdo con el Ministerio de Salud de la Nación y en base a la situación epidemiológica, consideren el resultado como positivo.
Diferencias entre los test comunes y los autotests
A diferencia de los test de uso profesional donde la toma de muestra es a nivel nasofaríngeo, en el caso de los test de autoevaluación se realiza a nivel nasal o bien por saliva, según lo especifique el fabricante.

Por ello, es muy importante que la toma de muestra se lleve a cabo en forma correcta y que de inmediato se realice la prueba para evitar resultados erróneos.
Además es necesario tener en cuenta que si la persona no tiene síntomas o si la carga viral es baja (lo que puede ocurrir durante los días iniciales o finales de la infección), el COVID-19 puede ser no detectado por el test, por lo que un resultado negativo no descarta la infección.
¿En dos meses se termina la pandemia? Cómo proyectan que será el salto a la endemia
Para tener un seguimiento, los resultados deberán ser reportados de forma inmediata (en base al código de barra de cada empaque) una vez realizado el test, y se dispondrá de un plazo mayor cuando no hubiera sido utilizado, ya sea por el usuario individual o por un responsable de reporte en caso de gran volumen de test.

Los datos se alojarán en la base informática farmacéutica y serán informados al Sistema Nacional de Vigilancia de la Salud (SNVS) por las agrupaciones farmacéuticas habilitadas, en el caso de reporte de test de usuarios individuales o por instituciones públicas o privadas.
Los casos positivos serán integrados a la notificación de casos de COVID-19, mientras que los negativos serán clasificados como “negativo, sin clasificar”. Los casos de test inválido deberán repetirse para definir el resultado.
Si el farmacéutico no recibe el reporte del usuario una vez realizado el test, deberá informar de esa situación a la autoridad sanitaria jurisdiccional.
Esta herramienta fue implementada como test de autoevaluación desde el año pasado por países como Portugal, Francia, Países Bajos, Bélgica, Reino Unido, Italia, Alemania, España, Austria, Bulgaria y Estados Unidos.
A partir de la autorización de la Anmat, se comenzará la importación de los productos, por lo cual se requerirá de un lapso de tiempo para que estén disponibles en farmacia para su venta. Todavía no hay tiempos estimados aunque confían en que será en el muy corto plazo.








